- Patients / Public
- Le CHU
- Espace pro
Recherche et simulation
Structure interne et externe au CHU
STANDARD
02 32 88 89 90
JOINDRE UN PATIENT
02 32 88 11 11
02 32 88 89 90
02 32 88 11 11
Plus de 10 000 professionnels
qui prennent soin de vous au quotidien.
Multiples et aux symptômes variés, les cancers de la gorge touchent plus de 15 000
Une spécialité toujours très impactée par la flambée de troubles psychiatriques lors de la période
4 jours et 4 nuits en relais 15 professionnels de l’équipe de greffe rénale –
C’est l’un des cancers le plus fréquent : le 3e cancer chez l’homme et le
21
Juin
Journée normande des soins critiques et de médecine périopératoire
21/06/2024 @ 9 h 00 min – 17 h 00 min – La Journée normande
11
Juin
au
13
Juin
2024
Café-rencontre exposition Dessiner les rêves
11/06/2024 – 13/06/2024 @ 11 h 30 min – 14 h 00 min – Rencontrer
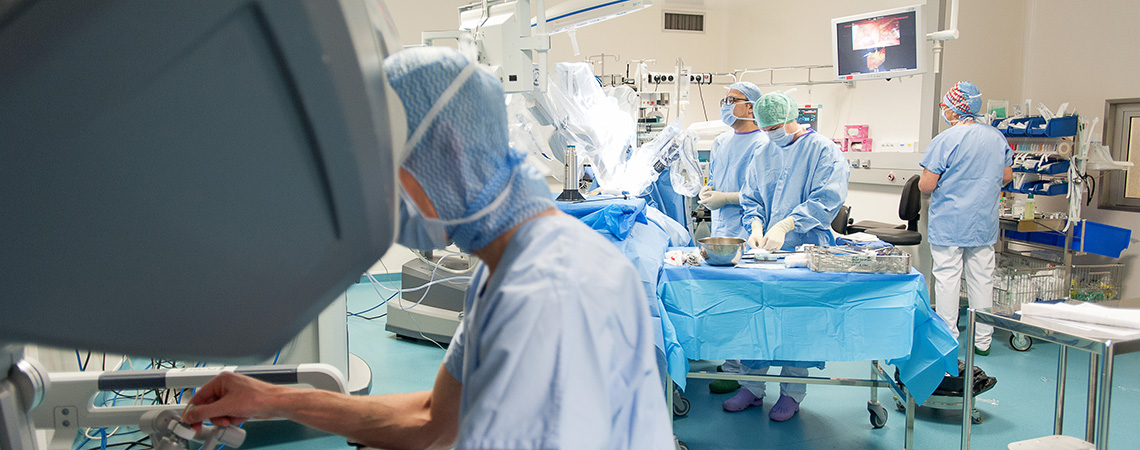
Les avantages de la chirurgie robot assistée Une utilisation multidisciplinaire en quoi consiste le robot chirurgical ? Contrairement aux idées reçues, le robot chirurgical n’opère pas seul le patient mais n’est qu’une « marionnette » contrôlée par le chirurgien. On parle alors de chirurgie robot assistée.La cœlioscopie est la technique chirurgicale utilisée
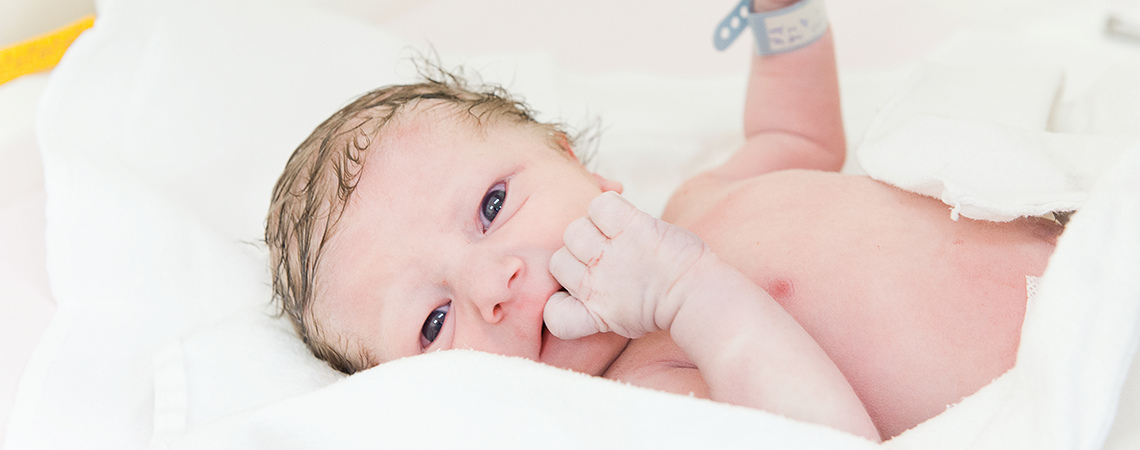
La maternité du CHU de Rouen vous accompagne tout au long de votre grossesse et vous propose un suivi personnalisé. La préparation à la naissance et à la parentalité, les consultations, les échographies peuvent être faites sur place pour un suivi simplifié. Visitez le site internet de la maternité du

Hôpital Charles-Nicolle
37 boulevard Gambetta – 76031 Rouen
Hôpital de Bois Guillaume
147 avenue du Maréchal Juin – 76230 Bois-Guillaume
Hôpital Saint Julien
rue Guillaume Lecointe – 76140 Le Petit-Quevilly
Hôpital de Oissel
rue Pierre Curie – 76350 Oissel
Hôpital de Boucicaut
13 rue Boucicaut – 76130 Mont-St-Aignan
Services d'urgences
116 117
32 37
02 35 15 81 27
144
SAMU